信噪比提升N个数量级!CUT&Tag:一款让基因组数据“背景”消失的神器

什么是CUT&Tag?
CUT&Tag(Cleavage Under Targets and Tagmentation)是一种主要用于研究蛋白质(如转录因子、组蛋白修饰等)与DNA相互作用的高通量测序技术。
我们可以把它理解为一个在细胞核内进行的“精准定位剪切”技术,其核心工作原理类似于“分子特洛伊木马”。
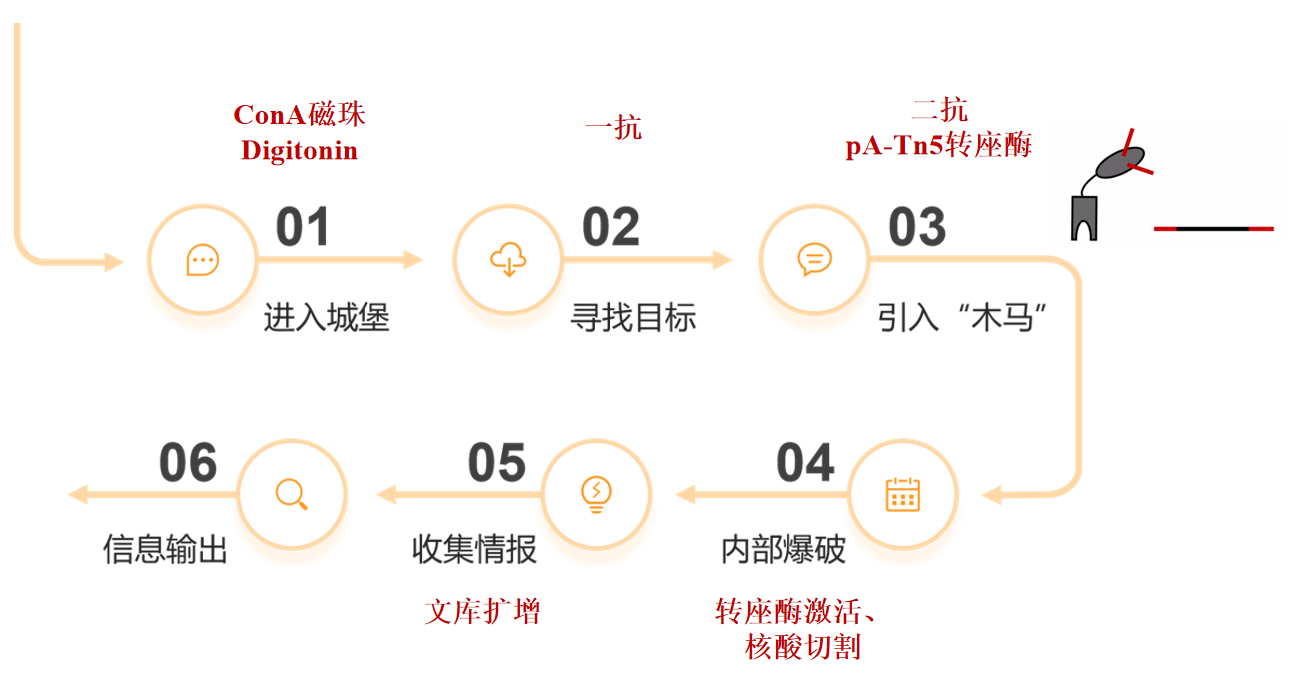
进入城堡:首先,保持细胞核的完整。用一种叫做洋地黄皂苷(Digitonin) 的试剂在细胞膜上打孔(通透),使得抗体能够进入细胞核,但核膜保持基本完整。
找到目标:加入一抗(Primary Antibody),这个抗体会特异性地结合到我们感兴趣的目标蛋白上(例如,结合在H3K27me3组蛋白上的抗体)。
引入“木马”:加入二抗(Secondary Antibody),这个二抗既能结合一抗,又能招募一个特殊的工程酶——pA-Tn5转座酶。pA是蛋白A,能强力结合抗体的Fc片段;Tn5是一个转座酶,能切割DNA并加上测序接头。此时,这个pA-Tn5复合物就像被抗体“导航”一样,被精确地带到了目标蛋白所在的基因组位置。
内部爆破:通过加入Mg²⁺来激活Tn5转座酶。被激活的Tn5会在被锚定的位置附近,对周围的DNA进行切割(Cleavage),同时在切割的断口上直接加上测序接头(Tagmentation)。
收集情报:将DNA从细胞核中释放出来,这些带接头的DNA片段就是目标蛋白曾经结合过的DNA区域。然后通过PCR扩增这些带接头的片段,构建成文库,进行高通量测序。
信息输出:通过测序分析,我们就可以得到一张全基因组范围内,目标蛋白(如转录因子、组蛋白修饰)在DNA上的结合位点图谱。
与同类技术对比的优劣势
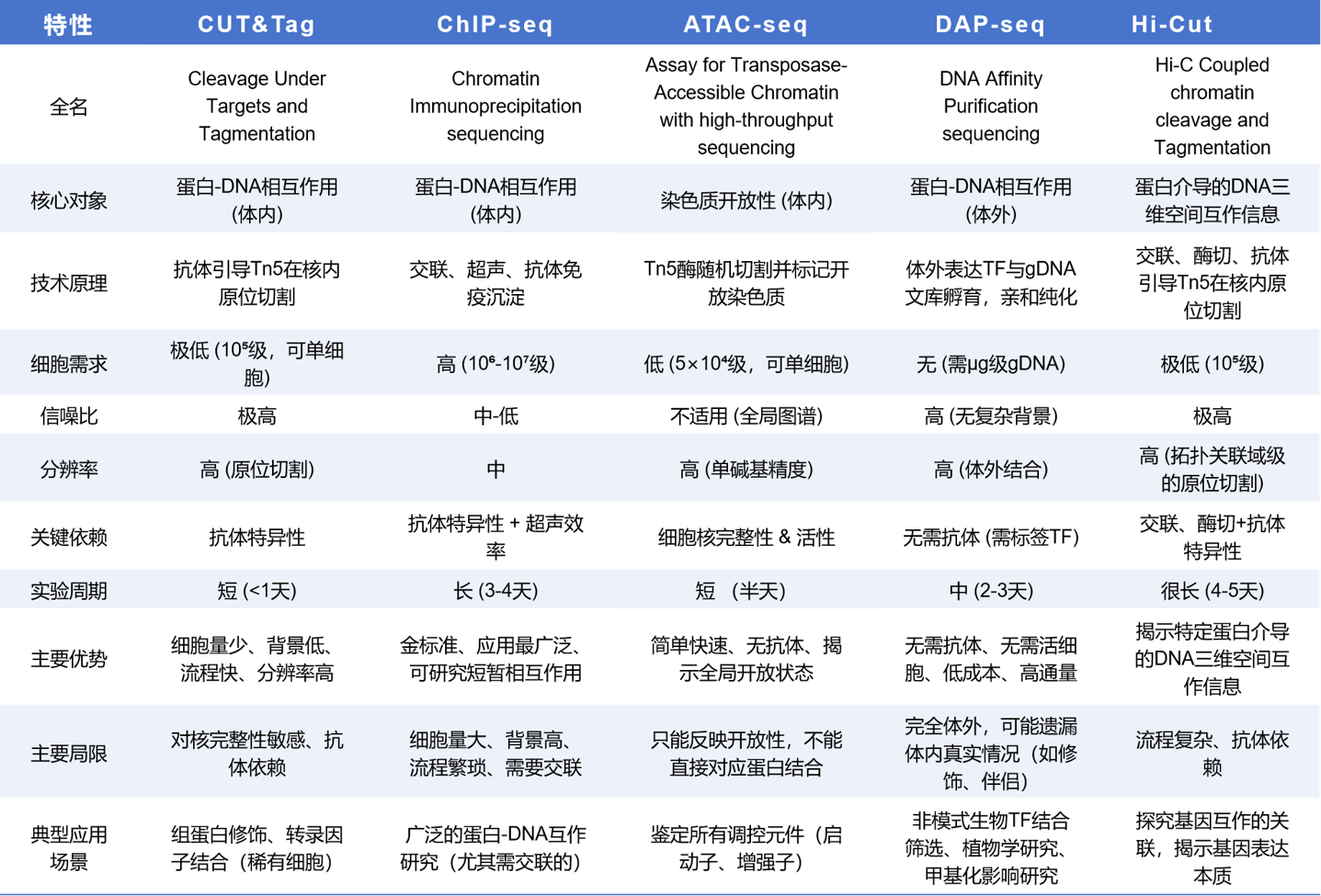
CUT&Tag最主要的对比对象是它的前身技术 ChIP-seq(染色质免疫沉淀测序),以及另一个改进技术 ATAC-seq(主要研究染色质开放性)。此外,随着技术的发展,目前还有DAP-seq和Hi-CUT等不同的技术形式。
CUT&Tag实验成功的关键因素
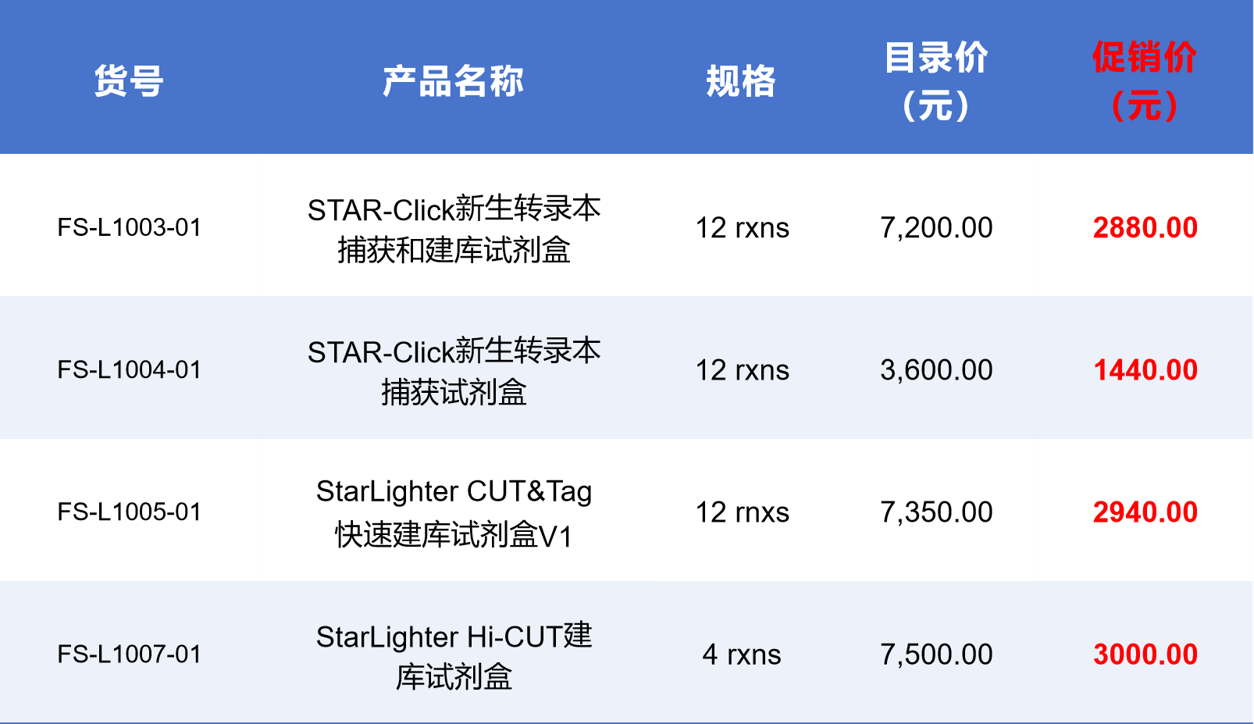
要想做好CUT&Tag实验,除了选用优质的CUT&Tag建库试剂盒(比如,FS-L1005,
StarLighter CuT&Tag 快速建库试剂盒 V1)外,还要注意实验操作上的各种关键因素。
细胞质量与数量
l 活性:使用生长状态良好、活性高(>90%)的细胞。死细胞会增加背景噪音。
l 数量:标准方案通常从100 -1,000,000个细胞开始。细胞量过少会导致文库复杂度低;过多则可能使通透化和洗涤不充分。
l 单细胞悬液:实验前必须将细胞吹打成单细胞悬液,任何细胞团块都会导致实验失败。
细胞通透性
l目的:让抗体和酶顺利进入细胞核,结合到目标染色质上。
l 通透不足:抗体和酶无法进入,导致信号微弱或无信号。
l 通透过度:细胞核结构被破坏,导致背景信号增高,甚至细胞核碎裂。理想状态是在显微镜下看到细胞形态完整但细胞膜被穿孔。
l 优化:必须针对不同细胞类型(尤其是原代细胞或组织)优化Digitonin的浓度和作用时间。
抗体质量与用量
l特异性:必须使用经过验证的高特异性、高效价的一抗。抗体的好坏直接决定了实验的成败。建议使用ChIP或IF验证过的抗体。
l 用量:抗体过量可能导致脱靶结合,增加背景;用量不足则导致信号弱。需要进行抗体滴定实验来优化。
结合与洗涤条件
l 温度与时间:一抗、二抗和pA-Tn5转座酶的结合需要在温和的摇床或旋转仪上进行,确保充分结合且细胞不结块。
l 洗涤:充分的洗涤至关重要,可以去除未结合和非特异性结合的抗体/酶,是降低背景的关键步骤。但洗涤过程也要轻柔,避免细胞损失。
标签化反应
l 激活:确保Mg²⁺被准确加入以激活pA-Tn5酶。
l 时间与温度:反应时间(通常为1小时)和温度(37℃)需要精确控制。时间过长或温度过高可能导致过度标签化,产生过多的短片段,影响后续测序;时间过短则标签化不足,文库产量低。
l 终止:使用SDS终止反应并释放DNA片段时,要确保充分混匀和孵育时间,以彻底灭活酶活性。
DNA纯化与文库扩增
l 纯化:一般使用磁珠纯化,以有效去除蛋白质等杂质。
l PCR循环数:由于CUT&Tag文库产量通常很高,应使用尽可能少的PCR循环数(通常12-15 cycles)来避免引入扩增偏倚和重复序列。建议先进行qPCR预实验来确定最佳循环数。
促销活动
sales promotion
活动日期:2025.9.10-2025.10.10




